Биопринтинг: технология 3D биопечати органов и тканей в медицине
Биопринтинг или 3d биопечать – одна из наиболее революционных технологий в современной медицине. Представьте себе, что можно напечатать на 3D-принтере не игрушку или инструмент, а целый орган для пересадки! Это уже не фантастика, а реальность, которая стремительно развивается.
В этой статье мы рассмотрим, что такое биопринтинг, как он работает, и какие перспективы и вызовы стоят перед этой технологией.
Содержание:
История биопринтинга: от первых экспериментов до современных технологий
Какие биологические материалы можно использовать для биопринтинга?
Какие вызовы и проблемы существуют в технологии 3d-печати органов?
#Что такое биопринтинг и как он работает в медицине?
#Определение биопринтинга и его основные принципы

Биопринтинг - это технология, которая использует трехмерное моделирование и послойное печатание для создания биологических структур. Применяя живые клетки и биоматериалы, биопринтер создает сложные каркасы тканей и органов. Основной принцип заключается в том, чтобы печатать слой за слоем, создавая трехмерные структуры, которые могут функционировать как естественные ткани и органы.
#Роль 3D-биопринтинга в современной медицине
В современной медицине 3D-биопринтинг играет ключевую роль. Эта технология имеет потенциал изменить подходы к лечению многочисленных заболеваний и позволяет создать органы и ткани на заказ для каждого пациента. Биопринтинг снижает зависимость от донорских органов и может значительно сократить списки ожидания на пересадку, а также уменьшить риск отторжения, так как органы создаются из клеток самого пациента.
#Важные этапы процесса биопечати
Процесс биопечати состоит из нескольких важных этапов. Во-первых, осуществляется трехмерное моделирование органа или ткани на компьютере. Затем создаются биочернила, которые содержат живые клетки и биоматериалы.
Далее, биопринтер послойно печатает структуру. После печати, напечатанные органы или ткани помещаются в биореактор, где они созревают и становятся функциональными. Последний этап - трансплантация готового органа или ткани пациенту.
#История биопринтинга: от первых экспериментов до современных технологий
#Ранние попытки и достижения в области 3d-печати органов

История биопринтинга начинается с ранних попыток использования обычных 3D-принтеров для печати элементов хряща и костей. В 1990-х годах исследователи начали экспериментировать с печатью биологических материалов, что положило начало развитию технологии биопринтинга.
Основная идея заключалась в том, чтобы заменить традиционные материалы на биочернила, содержащие живые клетки. Эти первоначальные эксперименты стали основой для последующего развития технологии, направленной на создание функциональных тканей и органов.
Первым 3D-печатным органом, который был пересажен человеку, стал мочевой пузырь, созданный в 1999 году учеными из Института регенеративной медицины Уэйк Форест. И он по-прежнему полностью функционирует спустя более чем пару десятилетий.
#Ранние достижения и ключевые этапы в истории биопринтинга
1990-е годы:
- Первоначальные эксперименты: Исследователи начали использовать модифицированные 3D-принтеры для печати с биоматериалами, обычно называемыми биочернилами. Основным направлением этих экспериментов была печать структур, таких как хрящ и кость.2000-е годы:
- Первые успехи: В этот период начались более целенаправленные исследования в области печати с использованием клеток. Были проведены эксперименты по созданию трехмерных структур с использованием живых клеток и гелей.
- Органоидные структуры: В середине 2000-х годов ученые начали печатать небольшие "органы" и тканевые структуры, такие как кусочки кожи, хряща и простейшие сосуды.2010-е годы:
- Развитие биочернил: В этот период произошло значительное улучшение формул биочернил, что позволило печатать более сложные и многофункциональные структуры.
- Прогресс в создании органов: Ученые смогли напечатать более сложные органы, такие как части сердца, печени и легких, хотя функциональность этих органов все еще оставляет желать лучшего.
- Появление биопринтеров нового поколения: Были разработаны специализированные биопринтеры, подходящие для печати сложных биологических структур, что значительно улучшило точность и функциональные характеристики созданных тканей.
#Современные достижения
На сегодняшний день, биопринтинг продолжает развиваться и совершенствоваться. Ведутся работы по созданию функциональных органов для трансплантации. Одним из наиболее существенных достижений является создание тканевых матриц, которые могут поддерживать рост клеток, обеспечивая их жизнеспособность и функциональность.
#Как работает биопринтер
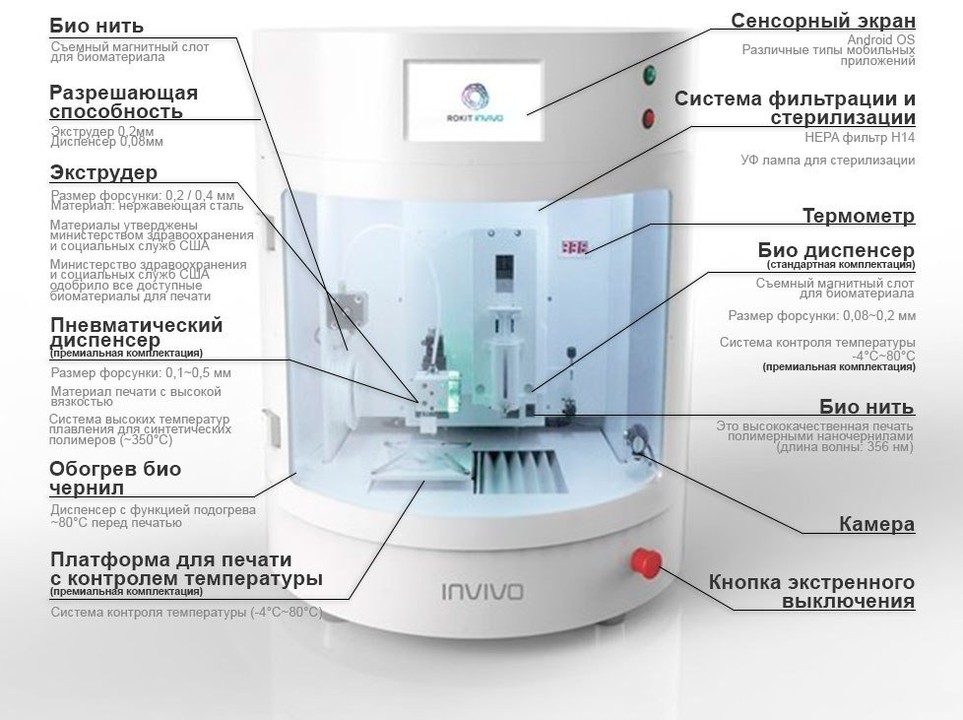
Биопринтеры — специализированные устройства, использующие принципы 3D-печати для создания биологических структур, таких как ткани и органы. Основные компоненты и этапы работы биопринтера включают следующие аспекты:
Материалы (биочернила):
Биопринтеры используют специальные материалы, которые называются биочернилами. Эти биочернила содержат живые клетки и биосовместимые гидрогели. Клетки могут быть стволовыми или специализированными, в зависимости от цели печати (например, клетки печени для печати печени).Дизайн и моделирование:
Процесс начинается с разработки компьютерной модели объекта. Для этого используют данные медицинских сканирований, такие как МРТ или КТ, которые преобразуются в цифровые 3D-модели. Полученная модель затем разбивается на слои.Процесс печати:
- Экструзионная печать: Один из наиболее распространенных методов, при котором биочернила экструзируются через форсунку (сопло) на подложку. Печать идет послойно, с постепенным наращиванием структуры.
- Лазерная асистированная печать: Этот метод использует лазер для сублимации клеток на подложку. Это обеспечивает высокую точность и минимальные повреждения клеток.
- Иньк-джет (струйная) печать: Биочернила экструзируются через маленькие сопла, подобно обычным струйным принтерам, но с использованием клеточных суспензий.Временное культивирование:
После завершения печати объект помещается в биореактор — специальный инкубатор, который поддерживает оптимальные условия для клеточной жизнедеятельности, такие как температура, влажность и уровень кислорода. В биореакторе клетки продолжают расти и интегрироваться друг с другом, формируя функциональную ткань.Созревание и проверка:
На этом этапе печатный объект проверяется на соответствие нужным механическим и функциональным характеристикам. Это может включать тестирование на механическую прочность, проницаемость и функциональные свойства, такие как реакция на биохимические стимулы.
Биопечать имеет огромное потенциал в медицине, включая создание органов для трансплантации, развитие персонализированной медицины, разработку новых лекарств и тестирование их на культуре тканей, что может уменьшить необходимость в тестировании на животных.
#Примеры успешно напечатанных органов для пересадки
Приведем несколько успешных примеров использования биопринтинга для создания органов.
#Женщине впервые в мире сделали новую 3D-принтерную дыхательную трубку
Важное событие для медицины: впервые в истории успешно пересадили пациенту орган, напечатанный на 3D-принтере. Сейчас пациентка из Кореи восстанавливается с новым дыхательным горлом, частично созданным из стволовых клеток другого человека.
Группа учёных, врачей и инженеров стали первыми, кто провёл такую операцию в сеульской больнице Святой Марии в 2023 году. Пациентка, 50-летняя женщина, потеряла часть трахеи после операции по удалению рака щитовидной железы.
По сути, новый орган у пациента состоит из хряща и слизистой оболочки (это такая влажная штука, которая находится в некоторых органах и полостях тела, например, в легких и носу).
Чтобы создать эти элементы, ученые взяли стволовые клетки из носа и хрящевые клетки других пациентов — клетки, которые обычно выбрасывают во время лечения заложенности носа или после операции по удалению носовой перегородки.
Но 3D-печатная трахея также включает поликапролактон (PCL) для поддержки структуры и биочернила. Биочернила — это не те чернила, которые вы найдете в своем домашнем принтере, а живые клетки, необходимые для создания живой ткани при 3D-биопечати.
Однако у PCL есть срок службы. Так как он биоразлагаемый, срок службы всего около пяти лет. Тем не менее, ученые надеются, что за это время искусственный орган поможет организму пациента восстановить собственную трахею.
#Аутологичная минимально манипулируемая гомологичная жировая ткань (AMHAT) для лечения незаживающих язв диабетической стопы
Осложнения диабетической стопы становятся все более обременительными для пациентов, клиницистов и общества.
Было проведено одномоментное пилотное исследование десяти последовательных пациентов с хронической язвой диабетической стопы (ЯДС), которым проводилось лечение аутологичной минимально манипулируемой гомологичной жировой тканью (AMHAT), выдаваемой специализированным 3D-биопринтером Dr. INVIVO. В исследование были включены пациенты с незаживающими ранами DFU, существующими более 4 недель и рефрактерными к стандартным методам лечения. Раны обрабатывались однократным нанесением AMHAT, после чего проводилось еженедельное наблюдение в течение 12 недель или до заживления ран. Первичным показателем была полная эпителизация раны через 12 недель после лечения. Вторичные показатели включали уменьшение размера и/или объема раны, оценку степени язвы и время до закрытия.
Результаты: Пять ран зажили к 5 неделям и одна - к 8 неделям. Среднее процентное уменьшение площади раны через 12 недель составило 78,3% (SD: 33,23). Полное закрытие было достигнуто в 60 % ран. Среднее время до закрытия этих ран составило 49,1 дня (95% ДИ, 29,9-68,3). Нежелательных явлений не отмечено.
#Реализованный кейс Top 3D Group
#Rokit Dr. INVIVO 4D6: 3D-биопринтер-инкубатор для восстановления костей и хрящей -

В 2023 году компания Top 3D Group поставила и внедрила в научно-исследовательские процессы 3D-биопринтер Rokit Dr. INVIVO 4D6 для Национального медицинского исследовательского центра имени академика Мешалкина.
Новосибирский Центр является одним из крупнейших в стране многопрофильных научных, клинических и образовательных учреждений, предоставляющих специализированную медицинскую помощь.
Среди перспективных исследовательских направлений Центра — научные работы в области клеточных технологий и создание новых биотехнологических расходных материалов для хирургии. Использование передового оборудования — важнейшее условие для реализации подобных задач.
3D-биопринтеры, способные создавать сложные объёмные структуры из биоматериалов, включая живые клетки, представляют собой многообещающую категорию специализированного оборудования.
Центр приобрёл 3D-биопринтер Rokit 4D6 для исследований по восстановлению костной и хрящевой тканей. В качестве расходных материалов исследователи намерены использовать биочернила INVIVO GEL, которые подходят для широкого спектра применений в биотехнологической сфере.
#Какие биологические материалы можно использовать для биопринтинга?
#Типы биоматериалов, применяемых в биопечати

В биопечати используются различные биоматериалы, такие как гидрогели, поли(лактова-ко-гликолиевая кислота) и коллаген. Гидрогели являются одним из наиболее популярных биоматериалов благодаря своей биосовместимости и способности удерживать клетки. Полимерные материалы, такие как поли(лактова-ко-гликолиевая кислота), обладают механической прочностью и позволяют создавать структурные компоненты органов и тканей. Основные типы биоматериалов включают:
Гидрогели:
- Агароза и альгинат: Используются благодаря своей биосовместимости и способности удерживать воду, что создает оптимальные условия для роста клеток.
- Гиалуроновая кислота: Обладает отличными биоразлагаемыми и биосовместимыми свойствами, часто используется для создания мягких тканей.
- Метакрилованные гидрогели (например, PEGDA): Позволяют создавать структуры с контролируемыми механическими свойствами путем стереолитографического отверждения.Полимеры:
- Поли(лактова-ко-гликолиевая кислота) (PLGA): Привлекает своей биоразлагаемостью и механической прочностью, что делает его подходящим материалом для создания тканевых структур.
- Полиэтилен гликоль (PEG): Часто используется в комбинации с другими материалами для улучшения биосовместимости и механических свойств.Природные полимеры:
- Коллаген: Один из основных компонентов внеклеточного матрикса в теле человека, обеспечивающий структурную поддержку клеткам и тканям.
- Желатин: Производное коллагена, часто используемое благодаря своей совместимости с клетками и биодеградируемости.
- Фибрин: Используется из-за своих хороших механических свойств и способности стимулировать клеточную миграцию и пролиферацию.Синтетические матриксы:
- Поли(капролактон) (PCL): Синтетический полиэфир, применяемый благодаря своей медленной деградации и прочности.
- Поли(гидроксиэтилметакрилат) (pHEMA): Известен своим хорошим биосовместимым профилем.Биоразлагаемые металлы:
- Магний и его сплавы: Исследуются для использования в биопечати за счет возможности биоразложения в организме.
Каждый из этих биоматериалов обладает своими уникальными свойствами и может быть выбран в зависимости от конкретных требований, таких как тип ткани, механическая прочность, скорость деградации и биосовместимость.
#Преимущества и недостатки разных биоматериалов

У каждого биоматериала есть свои плюсы и минусы. Гидрогели хороши для создания мягких тканей, но могут быть недостаточно прочными для структурных компонентов. Полимерные материалы обеспечивают механическую поддержку, но могут вызвать воспалительные реакции. Коллаген является естественным компонентом человеческой ткани, но его получение в достаточном количестве может быть сложным и дорогостоящим. Композитные материалы, совмещающие преимущества различных биоматериалов, являются перспективным направлением исследований. Вот таблица, которая включает преимущества и недостатки различных биоматериалов:
#Важность жизнеспособности клеток
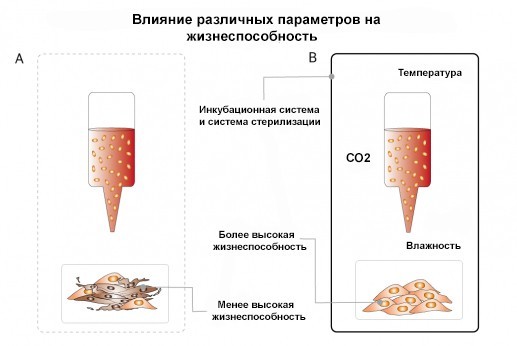
Жизнеспособность клеток - критический фактор в процессе биопринтинга. Важно, чтобы клетки сохраняли свою способность к делению и функционированию после печати. Это требует тщательного контроля условий печати и использования биоматериалов, которые поддерживают клеточную активность. Правильные условия культивирования и послепечатной инкубации также играют важную роль в обеспечении жизнеспособности клеток. Вот несколько аспектов, которые подчеркивают значение жизнеспособности клеток:
Качество биоматериалов: Выбор биосовместимых материалов, таких как гидрогели, которые не только допускают печать, но и создают благоприятную среду для клеточной активности, имеет первостепенное значение. Биоматериалы должны поддерживать клеточные функции, включая адгезию, пролиферацию и дифференцировку.
Оптимизация условий печати: Воздействие внешних факторов, таких как температура, давление и скорость печати, и влажность может существенно повлиять на жизнеспособность клеток. Так, применение слишком высоких температур или чрезмерного механического давления может привести к гибели клеток или изменению их функциональности.
Стерильность условий: Поддержание стерильных условий во время печати и последующей инкубации предотвращает контаминацию, которая может серьёзно нарушить жизнеспособность клеток.
Состав среды культивирования: После завершения процесса печати клетки требуют подходящей питательной среды, содержащей необходимые элементы для роста и развития, такие как аминокислоты, витамины и факторы роста. Неправильный состав среды может привести к стрессу клеток и их гибели.
Постпечатная обработка и инкубация: После печати важно обеспечить оптимальные условия для первоначального прикрепления клеток к матрице (если это необходимо), а также для их дальнейшего роста и адаптации. Это может включать контролируемую подачу кислорода, питательных веществ и удаление продуктов метаболизма.
Физико-химические условия: Важность имеет регулирование pH, осмотического давления и содержания растворённых газов (например, кислорода и углекислого газа) в окружающей среде.
Мониторинг и оценка: Регулярное наблюдение за состоянием клеток позволяет оперативно вносить коррективы в условия их содержания или в процесс печати. Методы оценки жизнеспособности клеток, такие как тесты на мембранную целостность и метаболическую активность, являются стандартной практикой.
Обеспечение жизнеспособности клеток является непрерывным процессом, требующим междисциплинарного подхода и тесного сотрудничества между биологами, химиками, инженерами и специалистами по материалам.
#Что можно создать на биопринтере
Биопринтеры открывают захватывающие возможности в медицине и биотехнологии. Вот некоторые из вещей, которые можно создать на биопринтере:
Ткани для трансплантации: Одно из самых перспективных направлений — это создание тканей для пересадок. Это могут быть кожные покрытия для лечения ожогов, хрящевые ткани для лечения суставов или кровеносные сосуды.
Органы: Создание полноценных функциональных органов, таких как почки, печень или сердце, пока находится на стадии исследований и разработки. Тем не менее, уже есть успешные примеры создания более простых органоидов — мини-моделей органов, которые могут быть полезны для тестирования лекарств.
Печатные модели для обучения: Биопринтеры могут создавать модели органов и тканей для учебных целей в медицине. Это позволяет медицинским специалистам тренироваться на реалистичных структурах.
Каркасы для регенерации тканей: Биопринтеры могут создавать пористые носители или каркасы, которые затем заселены клетками и стимулируют рост новых тканей внутри организма.
Модели болезней: Биопринтеры могут быть использованы для создания моделей заболеваний на основе человеческих клеток и тканей. Это помогает в изучении патологий и тестировании новых медикаментов.
Персонализированные медицинские решения: Биопринтеры можно использовать для создания персонализированных медицинских изделий, таких как протезы или имплантаты, которые точно соответствуют анатомии пациента.
Пищевая продукция: Хотя это касается большей степени другой области, биопринтеры также используются для создания пищевых продуктов, имитирующих мясо и другие продукты, что является прямым продолжением технологий биопечати.
Биопринтинг — это быстро развивающаяся область, и многие из этих приложений всё ещё находятся на этапе исследования и разработки. Однако уже сейчас существует ясное понимание того, что потенциал этой технологии огромен и может кардинально изменить многие аспекты медицины и биотехнологий.
#Можно ли пересаживать напечатанные органы?
Пересадка напечатанных органов — это одна из самых инновационных и перспективных областей биомедицинских исследований. Однако полностью функционирующие напечатанные органы, готовые для пересадки в человека, еще не стали реальностью.
Некоторые достижения включают:
Простые ткани и структуры: Исследователи уже успешно напечатали и пересадили простые ткани и структуры, такие как кожа, хрящи и кровеносные сосуды.
Масштабные исследования: Ведется работа по созданию более сложных органов, таких как печень, почки и сердце, но на данный момент эти органы еще не готовы для клинических испытаний.
Трудности и вызовы: Сложность в создании напечатанных органов заключается в воспроизведении сложной архитектуры и функциональности живой ткани, включая кровоснабжение, иннервацию и взаимодействие различных типов клеток.
Хотя перспективы и очень многообещающие, все еще требуется значительное количество исследований и клинических испытаний перед тем, как напечатанные органы смогут стать стандартом в трансплантологии.
#Какие вызовы и проблемы существуют в технологии 3d-печати органов?

#Трудности в обеспечении функциональности напечатанных органов
Одна из главных трудностей заключается в обеспечении функциональности напечатанных органов. Биопринтинг позволяет создавать структуры, которые внешне похожи на настоящие органы, но добиться их полного функционального соответствия - сложная задача. Необходимо интегрировать кровеносные сосуды, нервные окончания и другие микроэлементы, чтобы органы могли выполнять свои функции в организме пациента.
#Перспективы и ограничения биопечати в клинической практике
Несмотря на огромные перспективы, биопечать сталкивается с рядом ограничений. Одним из главных ограничений является масштабируемость технологий - сложно создать крупные органы с достаточной точностью и функциональностью. Еще одна проблема - безопасность и проверка напечатанных органов на соответствие медицинским стандартам. Тем не менее, перспективы биопечати в клинической практике огромны, и ученые активно работают над преодолением этих ограничений.
#Этические и правовые аспекты биопринтинга
Биопринтинг поднимает множество этических и правовых вопросов. Использование живых клеток и создание органов на заказ вызывает дискуссии по поводу моральности таких методов. Важно, чтобы технологии биопринтинга развивались в соответствии с этическими нормами и правовыми стандартами. Нужно обеспечить, чтобы доступ к технологиям был справедливым и регулировался соответствующими органами.
Итак, биопринтинг - это инновационная техника, которая открывает новые горизонты в медицине и трансплантации органов. От первых экспериментов до современных достижений биопринтинг прошел долгий путь, и будущее этой технологии кажется светлым и перспективным. Однако, на пути к широкому применению технологии предстоит решить множество научных, технических и этических вопросов. Но несомненно одно - 3d-биопринтинг уже меняет мир медицины и продолжит делать это в будущем.